科室动态
王培昌教授/宋乔助理研究员阐述脑细胞衰老与AD病理互作机制
2025年10月21日,首都医科大学宣武医院检验科王培昌教授/宋乔助理研究员团队在国际著名阿尔茨海默病(AD)专业期刊《Alzheimer's & Dementia》在线发表题为“Entwined Processes in Alzheimer’s Disease: Brain Cellular Senescence and Alzheimer’s Disease Pathology”的论文。该文聚焦脑细胞衰老和AD病理(Aβ沉积与tau过度磷酸化等)的相互作用,系统阐述了AD病理如何诱导各类脑细胞衰老、各类脑细胞衰老又如何加重AD病理进展、以及衰老脑细胞和AD病理如何相互作用形成恶性循环进而促进AD快速进展。李雯博士生为该论文第一作者,王培昌教授、宋乔助理研究员为该论文共同通讯作者。

AD是最常见的与年龄相关的神经退行性疾病之一,其主要病理特征包括β-淀粉样蛋白(Aβ)沉积所形成的老年斑和tau蛋白过度磷酸化导致的神经纤维缠结。鉴于针对AD经典理论学说关键靶点治疗药物III期临床试验的失败,提示既往AD主要理论学说均不是AD发生发展的主因,并提示“揭示AD发生发展的主因是破解AD治疗瓶颈的唯一路径”。本文系统性地提出并论证了一个全新的、动态的病理模型:脑细胞衰老与AD病理之间存在着相互作用的恶性循环。该模型不仅将脑细胞衰老从“伴随现象”提升为AD发病机制的核心驱动因素,更揭示了每种脑细胞在AD发生发展中扮演的关键作用,为理解AD的复杂病理进程提供了全新视角。
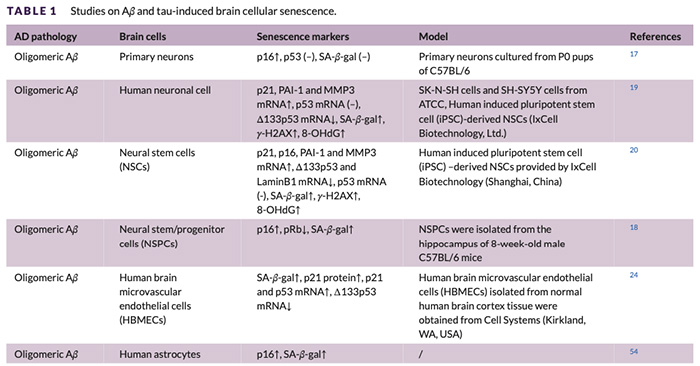
该文首先系统梳理了AD病理作为慢性应激源,如何诱导不同类型脑细胞衰老。按照细胞类型详细分述了神经干细胞、神经元、星形胶质细胞、小胶质细胞和少突胶质前体细胞在Aβ和磷酸化tau蛋白刺激下,在体内外细胞衰老表型和衰老标志物的变化,如出现脂褐素积累、核增大等衰老表型,p16/p21表达上调、衰老相关中性β-半乳糖苷酶(SA-β-GAL)阳性率升高等,均提示AD病理加速了各类脑细胞衰老。深入分析发现,Aβ、p-tau/NFT可通过不同分子通路(如氧化应激与炎症反应、DNA损伤、线粒体功能损伤、cGAS-STING、p38-MAPK、NLRP3等)促进各类脑细胞衰老。
该文亦详细阐述了各种衰老脑细胞如何加剧AD病理,论述了衰老细胞如何从AD病理的“被动受害者”转变为疾病进展的“主动推动者”。神经元衰老表型与HuD蛋白下调相关,而HuD蛋白的下调促进了Aβ的生成和tau蛋白的过度磷酸化。衰老星形胶质细胞通过NF-κB通路上调APP和BACE1表达,并由于溶酶体功能障碍及清除受体的表达下降,导致Aβ降解受阻。衰老小胶质细胞则表现出吞噬功能受损,且通过分泌IL-1β、IL-6等促炎因子激活CDK5/p38-MAPK通路,进一步促进tau蛋白磷酸化。而衰老少突胶质细胞和衰老的血管细胞(内皮细胞和周细胞)则分别通过影响髓鞘功能和血脑屏障完整性,促进Aβ和tau蛋白磷酸化。
AD病理和各类衰老脑细胞相互作用,形成恶性循环,不断促进AD的发生发展。慢性炎症、血脑屏障损伤、神经元丢失和突触退行性变是维系并加速这一恶性循环的三大关键节点。衰老细胞分泌的SASP是神经炎症的持续来源,其通过激活NLRP3等炎症小体,进一步促进Aβ和磷酸化tau蛋白的产生,而Aβ和磷酸化tau蛋白又能激活炎症通路。AD病理和衰老细胞共同破坏BBB完整性,导致Aβ清除障碍和外周毒性物质入脑,进一步诱发神经炎症和神经元损伤。上述的病理过程都会导致突触可塑性受损和神经元死亡,加重认知功能衰退。而清除衰老脑细胞可显著改善AD模型小鼠的认知功能,提示,基于各类脑细胞尤其是海马神经元衰老干预可能是未来AD新型治疗策略。上述研究结果也提示AD病理进展中衰老相关关键分子有成为AD早期新型标志物的潜能。
本研究由国家自然科学基金青年项目(82402715)、国家自然科学基金重点项目(82030064)资助。